上一回,我們著重講述了 有了 RNA-seq 還需要蛋白質(zhì)檢測嗎? 其中幾個關鍵參數(shù)大家一定記住了吧!比如在全基因組中,mRNA 和蛋白質(zhì)表達水平之間的相關性很差,在許多研究中的解釋力(explanatory power)徘徊在 40% 左右。這一回,我們來講述如何進行蛋白質(zhì)檢測。
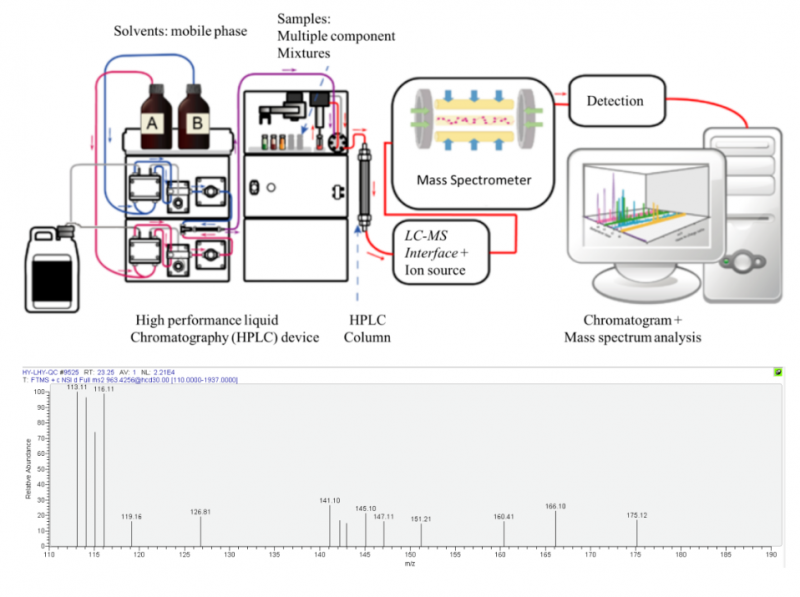
蛋白質(zhì)檢測首先我們想到的是質(zhì)譜((mass spectrometry)技術。
質(zhì)譜技術: 通過對化合物分子進行電離,生成不同質(zhì)荷比(m/e)的離子,經(jīng)加速電場的作用進入質(zhì)量分析器。在質(zhì)量分析器中,再利用電場和磁場使發(fā)生相反的速度色散,將它們分別聚焦而得到質(zhì)譜圖。質(zhì)譜圖中的橫坐標表示離子的質(zhì)荷比值,縱坐標表示離子流的強度。
蛋白質(zhì)組學檢測,在應用質(zhì)譜技術的基礎上發(fā)展了很多具體的方法:
不帶標記的 label free
帶標記的 iTRAQ(isobarictags for relative and absolute quantitation, 同位素標記相對和 jué對定量)
帶標記的 TMT(Tandem Mass Tags, 串聯(lián)質(zhì)量標簽)
非常高級的似乎全能的 DIA(Data Independent Acquisition, 數(shù)據(jù)非依賴性采集)
低通量的 PRM(Parallel Reaction Monitoring, 平行反應監(jiān)視)
不帶標記的 label free
Label free 是基礎的了。與帶標記的 iTRAQ 和 TMT 相比,樣本不加標簽,每個樣本單獨上機。只分析質(zhì)譜數(shù)據(jù),比較不同樣品中相應肽段的信號強度,從而對肽段對應的蛋白質(zhì)進行相對定量。由于它的技術原理所限,對儀器的穩(wěn)定性、實驗人員的操作等可能產(chǎn)生系統(tǒng)誤差的因素要求極高,進而造成數(shù)據(jù)重現(xiàn)性較差。當然 label free 也有自己的優(yōu)勢,由于價格比較便宜,在臨床實驗時由于很多情況下都有十來個重復可以降低單個樣品定量不準的風險,也就是說那種一測大幾十個、上百個的時候還是可以選擇的。還有一種情況,部分老師僅僅是想看看蛋白“有還是無”的,也是可以用 label free 的。還另有適用情況,比如泛素化修飾檢測只能用 label free,這個我們后面講修飾組的時候再細講。
帶標記的 iTRAQ/TMT
iTRAQ/TMT 是都是先將蛋白進行標記的,只是標記的基團不同。以 iTRAQ 舉例說明,iTRAQ 即同位素標記相對和 jué對定量,使用同位素對不同樣品進行標記,然后將同一批樣品一起上機進行檢測,根據(jù)不同的同位素標記來區(qū)分各個樣品中 不同蛋白的表達量。優(yōu)勢是:定量準確,數(shù)據(jù)重現(xiàn)性好,靈敏度高對樣品要求量低,檢測蛋白數(shù)量多。缺點是由于同位素標記較多的只有 16 種(對,現(xiàn)在新出了 16 標的試劑盒!比以前同時標記的數(shù)量增加了),樣品量大(不考慮生物學重復的實驗點大于 16 個時)的時候需要在每次上機時加內(nèi)參樣品,增加了成本。樣品量在不是特別多的情況下,iTRAQ/TMT 是目前做蛋白定量的技術。
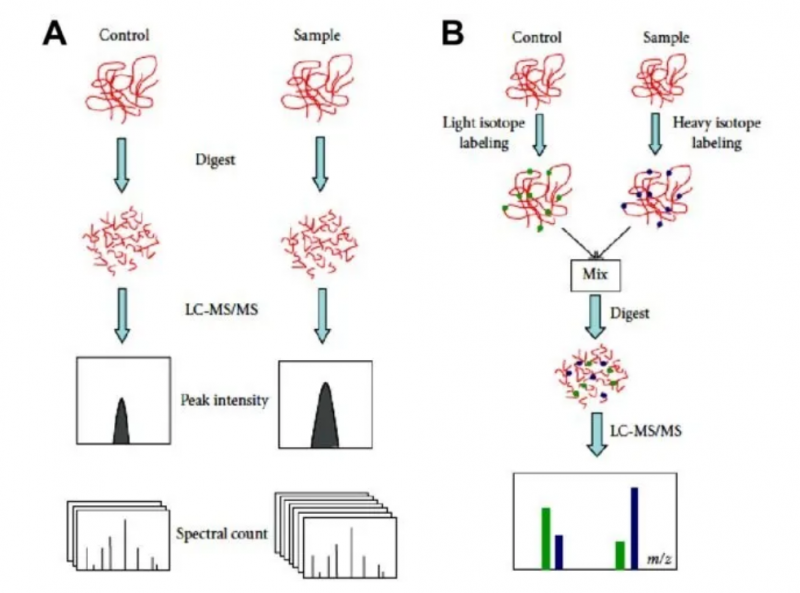
圖 label free(A) 和穩(wěn)定同位素標記定量(B) 之間的差異。Label free 定量包括兩個獨立進行的分析,然后進行比較。通過穩(wěn)定同位素標記的定量可以直接比較同位素標記的肽對。LC-MS/MS,液相色譜 - 串聯(lián)質(zhì)譜聯(lián)用。
非常高級似乎全能的 DIA 技術
和上面的三種技術,非常高級似乎全能的 DIA 技術是升級換代式的進步。上面的三種,采用的是 DDA(data-dependent acquisition,數(shù)據(jù)依賴采集)數(shù)據(jù)采集方式,其策略是對響應高的部分母離子進行二級采集。而 DIA(Data Independent Acquisition,數(shù)據(jù)非依賴采集)采用了不同的數(shù)據(jù)采集模式:將質(zhì)譜整個全掃描范圍分為若干個窗口,然后對每個窗口中的所有離子進行檢測、碎裂,從而無遺漏、無差異地獲得樣本中所有離子的信息,實現(xiàn)了從傳統(tǒng)的機槍掃射的方式向?qū)椶Z炸方式的采集方式轉(zhuǎn)變。
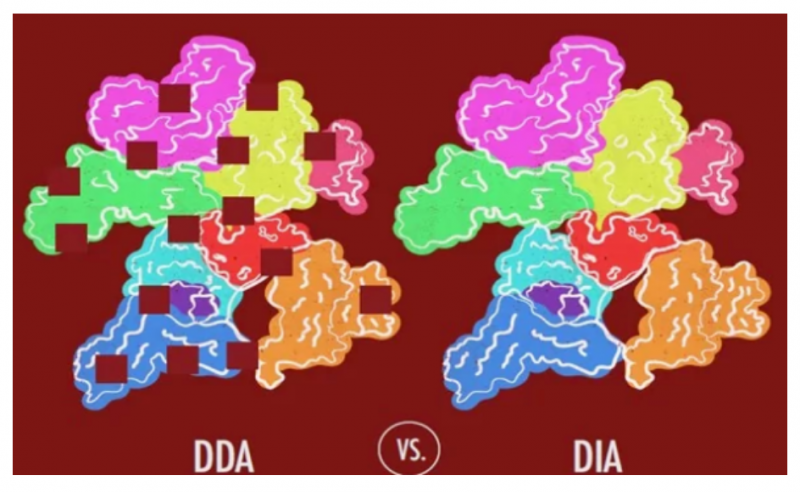
特別是對于血液,含有像白蛋白這樣的高豐度蛋白。在常規(guī)質(zhì)譜分析中,那些高豐度的蛋白常常會將具有意義的低豐度蛋白掩蓋。而 DIA 技術,無需去除高豐度的蛋白。
當然,DIA 也有其弱點,比如對儀器的要求、價格等。所以,也不能完全取代之前的技術。要根據(jù)需求選擇。
低通量的 PRM
PRM 能夠?qū)δ繕说鞍踪|(zhì)、目標肽段(如發(fā)生翻譯后修飾的肽段)進行選擇性檢測,從而實現(xiàn)對目標蛋白質(zhì) / 肽段進行 jué對定量。也就是說,是靶向的定量技術。PRM 和上述的幾種技術相比,就相當于 qPCR 之于二代測序。因此,可以用來驗證蛋白質(zhì)組的結(jié)果。當然,qPCR 做驗證,一般是做的單重 qPCR,而 PRM 可以輕松上到多重,我們試過一次檢測 50 個靶標。我們“古早”的蛋白驗證技術,像 Western Blot,可以被 PRM 代替的,而且 PRM 也不需要一抗。如果需要檢測的蛋白多,經(jīng)濟上算起來,PRM 更劃算呢!
當然,基于質(zhì)譜蛋白檢測應用發(fā)展的還有其它技術。上面介紹的 5 種技術是用得較多的。檢測蛋白的技術,可能還會想到免疫。當然我們這里要介紹的不是 Western Blot、ELISA 等傳統(tǒng)的免疫技術,而是高通量的蛋白芯片以及低通量的液相懸浮芯片。
蛋白芯片 類似于基因芯片,固相的板面上有整齊地排列著一個一個小點,這些小點可能是各種抗體,也可能是各種基因組的蛋白質(zhì)。通過抗原抗體及顯色反應,芯片上顯出或者亮或暗的點,以此篩查各種信號通路、蛋白表達。

液相懸浮芯片 ,我們前面介紹過 還不知道液相懸浮芯片?你 OUT 啦! 在蛋白檢測中的應用,主要是各種細胞因子檢測,即 Merck Millipore 公司的 Milliplex 高通量蛋白因子檢測芯片。它是一塊 96 孔板,每個孔里有偶聯(lián)上不同抗體的微珠。上樣后,經(jīng)過抗原抗體反應和顯色反應,可以得出每個樣本的不同因子的量。
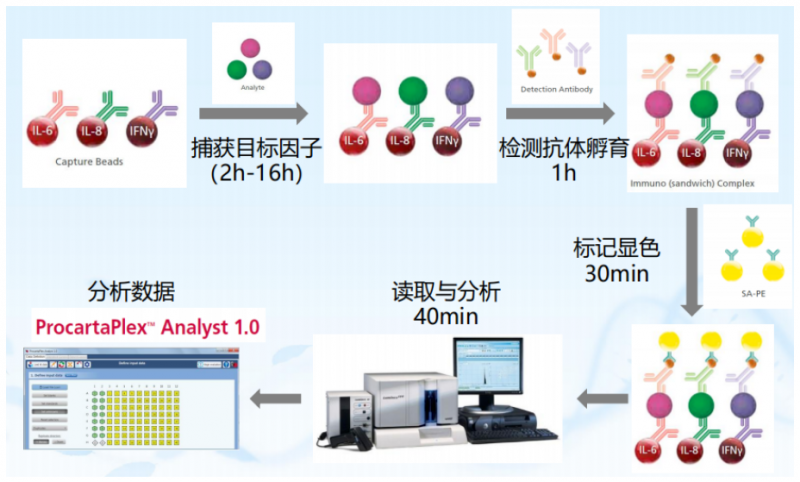
細胞因子(cytokines)是由免疫細胞(如單核、巨噬細胞、T 細胞、B 細胞、NK 細胞等)和某些非免疫細胞(內(nèi)皮細胞、表皮細胞、纖維母細胞等)經(jīng)刺激而合成、分泌的一類具有廣泛生物學活性的小分子蛋白質(zhì)。也就是說,Miliplex 檢測的是各種液體,包括體液、灌洗液。
以上,我們介紹了基于質(zhì)譜和基于免疫反應兩大類常見的蛋白質(zhì)檢測技術。下面幾回,我們會進行一些案做的分享。 有了 RNA-seq,,還需要蛋白質(zhì)檢測嗎?

